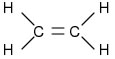ATIVIDADE 2A
REVISÃO GERAL -1 –
EXERCÍCIOS DE QUÍMICA
1.1 ATOMÍSTICA (Caso necessário, consulte a tabela periódica
dos elementos).
1. (UNESP) O íon 19
K39 + possui:
a) 19 prótons.
b) 19 nêutrons.
c) 39 elétrons.
d) número de massa igual a 20.
e) número atômico igual a 39.
2 (UEPG) Tendo por base o modelo atômico atual, assinale o
que for correto.
(01) Os elétrons movimentam-se ao redor do núcleo em órbitas
definidas de energia.
(02) Um elétron, quando excitado, pode passar de um nível de
energia para outro, através do salto quântico.
(04) A massa do átomo não está igualmente distribuída em sua
estrutura, concentrando-se na eletrosfera.
(08) Átomos neutros no estado fundamental apresentam igual
número de prótons e elétrons.
4) Considere a representação do átomo de alumínio no estado
fundamental: 13Aℓ27
. Convencionando-se para o primeiro elétron de um orbital S = - 1/2, assinale o
que for correto sobre esse átomo.
(01) Apresenta 4 níveis energéticos em sua configuração.
(02) Em seu núcleo atômico há 14 nêutrons.
(04) Existem 3 elétrons no último nível energético de sua
distribuição eletrônica.
(08) O elétron mais energético desse átomo tem os seguintes
números quânticos: n = 3; l = 1; m = - 1; S = - 1/2.
(16) O número atômico do alumínio é 13, o que significa que
esse átomo apresenta 13 prótons.
5. A
periodicidade da energia de ionização pode ser explicada pelo modelo atômico de
a) Bohr.
b) Dalton.
c) Thomson.
d) Rutherford.
6. (UFC) Considere um átomo que apresenta os seguintes
números quânticos para o elétron de valência: n = 4, ℓ = 1 e m = 1. Com relação
a este átomo, é correto afirmar que:
a) pode ser um metal de transição.
b) pode possuir no máximo 20 elétrons.
c) possui raio atômico menor do que o carbono.
d) possui menor eletronegatividade do que o cálcio.
e) possui primeira energia de ionização maior do que a do
bário.
7. Em fogos de artifício, observam-se as colorações, quando
se adicionam sais de diferentes metais às misturas explosivas. As cores
produzidas resultam de transições eletrônicas. Ao mudar de camada, em torno do
núcleo atômico, os elétrons emitem energia nos comprimentos de ondas que
caracterizam as diversas cores. Esse fenômeno pode ser explicado pelo modelo
atômico proposto por
a) Niels Bohr.
b) Jonh
Dalton.
c) J.J.
Thomson.
d) Ernest Rutherford.
8. (UFR) Considere as seguintes características de um certo
elemento químico.
I - Ele é menos eletronegativo que o oxigênio.
II - Ele possui raio atômico menor que o berílio.
III - Ele possui eletroafinidade maior que o boro.
Esse elemento químico pode ser o
a) carbono.
b) enxofre.
c) alumínio.
d) magnésio.
e) flúor.
9. (PUC-RS) Um experimento conduzido pela equipe de
Rutherford consistiu no bombardeamento de finas lâminas de ouro, para estudo de
desvios de partículas alfa. Rutherford pôde observar que a maioria das
partículas alfa atravessava a fina lâmina de ouro, uma pequena parcela era
desviada de sua trajetória e uma outra pequena parcela era refletida.
Rutherford então idealizou um outro modelo atômico, que explicava os resultados
obtidos no experimento.
Em relação ao modelo de Rutherford, afirma-se que
I. o átomo é constituído por duas regiões distintas: o
núcleo e a eletrosfera.
II. o núcleo atômico é extremamente pequeno em relação ao
tamanho do átomo.
III. os elétrons estão situados na superfície de uma esfera
de carga positiva.
IV. os elétrons movimentam-se ao redor do núcleo em
trajetórias circulares, denominados níveis, com valores determinados de
energia.
As afirmativas corretas são, apenas,
a) I e II
b) I e III
c) II e IV
d) III e IV
e) I, II e III
11. (PUC-MG) Assinale a afirmativa que descreve
ADEQUADAMENTE a teoria atômica de Dalton.
Toda matéria é constituída de átomos:
a) os quais são formados por partículas positivas e
negativas.
b) os quais são formados por um núcleo positivo e por
elétrons que gravitam livremente em torno desse núcleo.
c) os quais são formados por um núcleo positivo e por
elétrons que gravitam em diferentes camadas eletrônicas.
d) e todos os átomos de um mesmo elemento são idênticos.
12. (UFRS) A experiência de Rutherford, que foi, na verdade,
realizada por dois de seus orientados, Hans Geiger e Ernest Marsden, serviu
para refutar especialmente o modelo atômico
a) de Bohr.
b) de Thomson.
c) planetário.
d) quântico.
e) de Dalton.
13. A
respeito das propriedades periódicas dos elementos químicos é correto afirmar
que
a) o raio do cátion é menor que o raio do átomo de origem.
b) a eletronegatividade dos halogênios cresce com o número
atômico.
c) os elementos com maior energia de ionização são os metais
alcalinos.
d) o caráter metálico dos elementos cresce nos períodos da
esquerda para a direita.
14. (UFSM) "Os habitantes dos cerritos, com o tempo,
foram aprendendo a plantar e a moldar potes de barro cozido."
A argila, da qual foram feitos os potes, tem como
constituinte principal o silicato de alumínio hidratado. Em relação aos
elementos alumínio e silício, analise as seguintes afirmativas:
I. Ambos são classificados como elementos representativos.
II. O alumínio possui 3 elétrons na camada de valência.
III. O raio atômico do silício é maior que o do alumínio,
pois o silício possui mais elétrons na camada de valência que o alumínio.
Está(ão) correta(s)
a) I apenas.
b) II apenas.
c) III apenas.
d) I e II apenas.
e) II e III apenas.
15 (UFSC) A irradiação é uma técnica utilizada na
conservação de alimentos para inibir a germinação, retardar o amadurecimento e
destruir bactérias patogênicas. Os isótopos césio 137 e cobalto 60 são muito
utilizados na obtenção de alimentos irradiados, que não contêm resíduos
radiativos e, portanto, não prejudicam a saúde.
Assinale a(s) proposição(ões) CORRETA(S).
(01) O número atômico do césio 137 é 55.
(02) Césio e cobalto são elementos de transição.
(04) O césio forma hidróxidos do tipo M(OH)‚.
(08) Os elétrons do cobalto estão distribuídos em quatro
níveis principais de energia.
(16) O átomo do cobalto 60 tem 27 nêutrons no núcleo.
(32) O elemento césio está localizado no quinto período e no
grupo1 da classificação periódica dos elementos.
16 (PUC-MG) Assinale a afirmativa a seguir que NÃO é uma
idéia que provém do modelo atômico de Dalton.
a) Átomos de um elemento podem ser transformados em átomos
de outros elementos por reações químicas.
b) Todos os átomos de um dado elemento têm propriedades
idênticas, as quais diferem das propriedades dos átomos de outros elementos.
c) Um elemento é composto de partículas indivisíveis e
diminutas chamadas átomos.
d) Compostos são formados quando átomos de diferentes
elementos se combinam em razões bem determinadas.
17 (PUC-MG) O modelo atômico de Rutherford NÃO inclui
especificamente:
a) nêutrons.
b) núcleo.
c) próton.
d) elétron.
18 (UFG) "... o carbono é tetravalente."
A. Kekulé,
1858
A distribuição eletrônica do carbono, no estado fundamental,
entretanto, mostra que ele é bivalente. Para que o carbono atenda ao postulado
de Kekulé, ele sofre
a) ressonância.
b) isomeria.
c) protonação.
d) hibridização.
e) efeito indutivo.
19 (UFPE) As primeiras energias de ionização de K (Z=19), Ca
(Z=20) e S (Z=16) são, respectivamente, 418,8 Kj.mol-1, 589,8 kJ .mol-1e
999,6 kJ .mol-1 .Alguns comentários sobre estes números podem ser
feitos.
1 - O enxofre apresenta a menor energia de ionização, pois é
o elemento de menor número atômico entre os três.
2 - A energia de ionização do potássio é a menor, pois se
trata de um elemento com apenas um elétron na última camada, o que facilita sua
remoção.
3 - A energia de ionização do potássio é menor do que a de
cálcio, pois este último apresenta número atômico maior e dois elétrons de
valência, estando com o mesmo número de camadas eletrônicas.
4 - As energias de ionização do potássio e do cálcio são
mais próximas, pois são elementos vizinhos na tabela periódica.
Está(ão) correto(s) apenas:
a) 1
b) 2
c) 3 e 4
d) 2 e 4
e) 2, 3 e 4
20 (UFPE) A descoberta do elemento boro (Z=5) é atribuída a
Sir Humprey Davy, Gay Lussac e L. J. Thenard, em 1808, simultaneamente, na
Inglaterra e na França. Somente com base no seu número atômico, muitas
informações sobre suas propriedades podem ser inferidas. A seguir estão
enunciadas algumas dessas propriedades, mas somente uma é correta.
a) Seu estado de oxidação mais comum é 2.
b) A estrutura de Lewis de sua molécula diatômica é :B:B:
c) Deve formar moléculas em que o átomo de boro não obedece
a regra do octeto.
d) Não forma compostos covalentes.
e) É um elemento do terceiro período da tabela periódica.
Professor : jair Maradonna