Hidrocarbonetos
Hidrocarbonetos são compostos que apresentam em sua composição átomos
de Carbono e Hidrogênio. Vejamos as características dos principais
Hidrocarbonetos:
- Alcanos: são hidrocarbonetos alifáticos saturados, isto é, apresentam cadeia aberta com simples ligações apenas.
Fórmula geral: CnH2n+2

Butano: C4H10
- Alcenos: ou olefinas, são hidrocarbonetos alifáticos insaturados que apresentam uma dupla ligação.
Fórmula geral: CnH2n
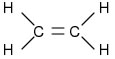
Eteno: C2H4
- Alcinos: são hidrocarbonetos alifáticos insaturados por uma tripla ligação.
Fórmula geral: CnH2n-2

Etino: C2H2, também conhecido como Acetileno.
- Alcadienos: são hidrocarbonetos alifáticos insaturados por duas ligações duplas.
Fórmula geral: CnH2n-2

1,3-Butadieno: C4H6
- Alcanos: são hidrocarbonetos alifáticos saturados, isto é, apresentam cadeia aberta com simples ligações apenas.
Fórmula geral: CnH2n+2

Butano: C4H10
- Alcenos: ou olefinas, são hidrocarbonetos alifáticos insaturados que apresentam uma dupla ligação.
Fórmula geral: CnH2n
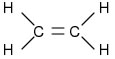
Eteno: C2H4
- Alcinos: são hidrocarbonetos alifáticos insaturados por uma tripla ligação.
Fórmula geral: CnH2n-2
Etino: C2H2, também conhecido como Acetileno.
- Alcadienos: são hidrocarbonetos alifáticos insaturados por duas ligações duplas.
Fórmula geral: CnH2n-2

1,3-Butadieno: C4H6
Hidrocarbonetos Cíclicos
- Cicloalcanos: apresentam cadeia fechada com apenas simples ligações.

Ciclohexano: C6H12
- Cicloalcenos: são hidrocarbonetos cíclicos insaturados por uma dupla ligação.

Ciclobuteno: C4H6
- Aromáticos: ou Arenos, são hidrocarbonetos em cuja estrutura existe pelo menos um anel benzênico (aromático).

Anel Benzeno: C6H6

Ciclohexano: C6H12
- Cicloalcenos: são hidrocarbonetos cíclicos insaturados por uma dupla ligação.

Ciclobuteno: C4H6
- Aromáticos: ou Arenos, são hidrocarbonetos em cuja estrutura existe pelo menos um anel benzênico (aromático).

Anel Benzeno: C6H6
Graduada em Química
Nomenclatura
FUNÇÃO HIDROCARBONETO (CxHy)
Os compostos pertencentes a esta função são constituídos exclusivamente por carbono e hidrogênio, portanto possuem fórmula geral: CxHy.
Os hidrocarbonetos são muito importantes porque formam o "esqueleto" das demais funções orgânicas.
Os Hidrocarbonetos estão divididos em várias classes, dentre as quais merecem destaque os alcanos, alcenos (alquenos), alcinos (alquinos), alcadienos, cicloalcanos, cicloalcenos e os hidrocarbonetos aromáticos.
ALCANOS OU PARAFINAS
São hidrocarbonetos saturados de cadeia aberta (acíclica). Possuem fórmula geral: CnH2n+2.
I. Fundamentos da Nomenclatura Orgânica:
PREFIXO + AFIXO + SUFIXO
Prefixo: indica o número de átomos de carbono pertencentes a cadeia principal.
| 1C = met | 6C = hex | 11C = undec | |
| 2C = et | 7C = hept | 12C = dodec | |
| 3C = prop | 8C = oct | 13C = tridec | |
| 4C = but | 9C = non | 15C = pentadec | |
| 5C = pent | 10C = dec | 20C = eicos |
Afixo ou infixo: indica o tipo de ligação entre os carbonos:
| todas simples = an | duas duplas = dien |
| uma dupla = en | três duplas = trien |
| uma tripla = in | duas triplas = diin |
Sufixo: indica a função química do composto orgânico:
hidrocarboneto= no
álcool= ol
aldeído= al
cetona= ona
ácido carboxílico= óico
amina= amina
éter= óxi
Nomenclatura dos Alcanos de Cadeia Normal:
Junta-se o prefixo + o infixo + o sufixo. Por exemplo: metano, etano, propano, butano, pentano, hexano, heptano, octano, nonano, decano, undecano, dodecano etc.
Grupos ou Grupamentos derivados dos alcanos.
Grupamento: é a estrutura que resulta ao se retirar um ou mais átomos de uma molécula.
Grupamento alquil(a) ou alcoil(a) é o grupamento formado a partir de um alcano pela retirada de um átomo de hidrogênio:
Obs.: Apesar da palavra radical ser muito usada ela está errada o nome correto é grupo ou grupamento: grupo metil (correto), radical metil (errado).
Nomenclatura dos Alcanos Ramificados.
Para dar nome a um alcano ramificado, basta você seguir as seguintes regras estabelecidas pela IUPAC:
1.º considerar como cadeia principal, a cadeia carbônica mais longa possível; se há mais de uma cadeia de mesmo comprimento, escolha como cadeia principal a mais ramificada.
2.º numere a cadeia principal de forma que as ramificações recebam os menores números possíveis (regra dos menores números).
3.º elaborar o nome do hidrocarboneto citando as ramificações em ordem alfabética, precedidos pelos seus números de colocação na cadeia principal e finalizar com o nome correspondente a cadeia principal.
4.º os números são separados uns dos outros por vírgulas.
5.º os números devem ser separados das palavras por hífens.
Obs.1: no caso de haver dois, três, quatro, etc. grupos iguais ligados na cadeia principal, usam-se os prefixos di, tri, tetra, etc. diante dos nomes dos grupos.
Obs.2: Os prefixos di, tri, tetra, iso, sec, terc, neo não são levados em consideração na colocação dos nomes em ordem alfabética.
ALCENOS OU OLEFINAS
Alcenos, alquenos, olefinas ou hidrocarbonetos etenilênicos são hidrocarbonetos de cadeia aberta (acíclicos) contendo uma única dupla ligação. Possuem fórmula geral CnH2n .
Nomenclatura dos Alcenos de Cadeia Normal e de Cadeia Ramificada
É muito semelhante a nomenclatura utilizada para os alcanos. Troca-se a terminação ano do alcano por eno
1) A cadeia principal é a mais longa que contém a dupla ligação.
2) A numeração da cadeia principal é sempre feita a partir da extremidade mais próxima da dupla ligação, independentemente das ramificações presentes na cadeia. No nome do alceno a posição da dupla é dada pelo número do primeiro carbono da dupla; esse número é escrito antes do nome do alceno.
3) Se houver mais de uma possibilidade para a cadeia principal adota-se a regra dos menores números.
ALCINOS OU ALQUINOS
Alcinos, alquinos ou hidrocarbonetos acetilênicos são hidrocarbonetos acíclicos contendo uma única ligação tripla. Possuem fórmula geral CnH2n-2.
Nomenclatura dos Alcinos de Cadeia Normal e de Cadeia Ramificada
É muito semelhante a nomenclatura utilizada para os alcanos. Troca-se a terminação ano do alcano por ino.
1) A cadeia principal é a maior cadeia que contenha a ligação tripla.
2) A numeração da cadeia é feita a partir da extremidade mais próxima da ligação tripla. (As outras regras vistas para os alcenos também valem par os alcinos).
ALCADIENOS
São hidrocarbonetos acíclicos (abertos) contendo duas duplas ligações. Possuem fórmula geral: CnH2n-2.
Nomenclatura dos Alcadienos de Cadeia Normal e de Cadeia Ramificada
I. A nomenclatura IUPAC é feita com a terminação DIENO.
II. A cadeia principal é a mais longa possível e deve conter as duas duplas ligações.
III. A numeração da cadeia se inicia pela extremidade mais próxima das duplas ligações de forma que as duplas ligações fiquem com os menores números possíveis.
IV. Em caso de empate na posição das duplas ligações, deve-se numerar a cadeia de forma que as ramificações fiquem com os menores números possíveis;
CICLANOS OU CICLOALCANOS OU CICLO-PARAFINAS
São hidrocarbonetos de cadeia cíclica (fechada) e saturada. Possuem fórmula geral CnH2n onde "n" deve ser maior ou igual a 3.
Nomenclatura dos Ciclanos de Cadeia Normal e de Cadeia Ramificada
I. O nome é dado adicionando-se o prefixo CICLO ao nome do alcano correspondente;
II. Quando a cadeia for ramificada, a numeração da cadeia se inicia a partir da ramificação mais simples e segue-se o sentido horário ou anti-horário, de maneira a se respeitar a regra dos menores números;
III. As ramificações devem ser citadas em ordem alfabética;
CICLENOS OU CICLO-ALQUENOS OU CICLO-OLEFINAS
São hidrocarbonetos cíclicos com uma dupla ligação. A fórmula geral é CnH2n-2;
Nomenclatura dos Ciclenos de Cadeia Normal e de Cadeia Ramificada
I. O nome é dado adicionando-se o prefixo CICLO ao nome do alceno correspondente;
II. Quando a cadeia for ramificada, a numeração da cadeia se inicia a partir do carbono da ligação dupla (a dupla deve ficar entre o carbono 1 e 2) e segue-se o sentido horário ou anti-horário, de maneira a se respeitar a regra dos menores números;
III. As ramificações devem ser citadas em ordem alfabética;
HIDROCARBONETO AROMÁTICO
São os hidrocarbonetos que possuem um ou mais anéis benzênicos, que também são chamados de anéis aromáticos.
Nomenclatura dos Hidrocarbonetos Aromáticos
I. A nomenclatura IUPAC considera os hidrocarbonetos aromáticos como derivados do benzeno;
II. Quando o anel benzênico possui mais de uma ramificação, a numeração da cadeia se inicia a partir da ramificação mais simples e segue-se o sentido horário ou anti-horário, de maneira a se respeitar a regra dos menores números;
III. Quando o anel benzênico possuir duas ramificações, iguais ou diferentes, pode-se usar a nomenclatura orto, meta, para, ao invés de numerar o anel benzênico. A posição 1,2 passa a ser indicada por orto ou simplesmente por "o", a posição 1,3 passa a ser indicada por meta ou simplesmente por "m" e finalmente a posição 1,4 passa a ser indicada por para ou simplesmente por "p".
IV. As ramificações devem ser citadas em ordem alfabética;
Por Alexandre Oliveira


